Equinococose
Formas
adultas de tenídeos do gênero Echinococcus
podem causar uma infecção em canídeos conhecida com equinococose. Esses tenídeos
possuem pequenas dimensões e a principal espécie é Echinococcus granulosus, cuja larva denominada de hidatidose parasita
o homem e animais domésticos. Essa zoonose acarreta danos à saúde pública e
perdas econômicas em diversas regiões do mundo, principalmente em zonas de
pecuária.
O que se percebe é que há uma possível relação entre a frequência do cisto hidático com a prevalência da equinococose nos cães de certa região. O Echinococus granulosus vem sendo encontrado em uma diversa gama de animais carnívoros silvestres na América do Sul, onde a prevalência é maior que nas ouras partes do mundo e ocasiona graves prejuízos econômicos. No Brasil, o estado que apresenta as maiores taxas de infecções hidáticas é o Rio Grande do Sul (Figura 2), no qual já foram descritos 470 casos de hidatidose cística no período entre os anos 1973 e 1984.
O que se percebe é que há uma possível relação entre a frequência do cisto hidático com a prevalência da equinococose nos cães de certa região. O Echinococus granulosus vem sendo encontrado em uma diversa gama de animais carnívoros silvestres na América do Sul, onde a prevalência é maior que nas ouras partes do mundo e ocasiona graves prejuízos econômicos. No Brasil, o estado que apresenta as maiores taxas de infecções hidáticas é o Rio Grande do Sul (Figura 2), no qual já foram descritos 470 casos de hidatidose cística no período entre os anos 1973 e 1984.
 |
Figura 2 - Prevalência da equinococose cística humana em alguns municípios
de áreas endêmicas do estado do Rio Grande do Sul. Adaptado de RUE (2008).
|
Esta parasitose tem maior ocorrência nas regiões
que apresentam grandiosa densidade em áreas de criação de gado. No Rio Grande
do Sul, as áreas consideradas mais endêmicas são aquelas formadas pelos
municípios que fazem fronteira com o Uruguai e seus adjacentes. Utilizando as
técnicas disponíveis em Biologia Molecular, se detectou a existência de
variedades intraespecíficas, ou seja, linhagens ou cepas, em E granulosus nesse estado.
A
hidatidose é uma parasitose considerada rural, porém, a sua ocorrência vem
aumentando nas áreas urbanas, em função da migração de cães infectados por E. granulosus provenientes de áreas
endêmicas. Nas áreas com alta densidade demográfica, a possibilidade de um cão
com equinococose infectar o homem com o cisto hidático é maior. O êxodo rural
trouxe o risco da hidatidose, que passou a ser considerada uma zoonose urbana
também. Com isso, é possível perceber que algumas zoonoses que antes eram
consideradas historicamente rurais, podem começar a apresentar ocorrência
elevadas nas cidades.
Apenas
alguns poucos países, exemplificados por Islândia e Irlanda, estão livres da
linhagem de E. granulosus. A
hidatidose tem grande distribuição nas áreas rurais da Bacia Mediterrânea, que
abrange os países do sul europeu (Itália, Espanha, Portugal). Além disso, está
presente nos seguintes locais: Egito, Líbia, Tunis, Argélia, Marrocos, Bulgária,
Romênia, Polônia, Rússia, África, Uruguai, Argentina, Brasil, Chile, Bolívia,
Peru, Ásia, Austrália, etc. A hidatidose humana é mais comum pela espécie E. granulosus do que por outras espécies
existentes Argentina, Bolívia, Chile, Colômbia, Equador, Peru, Uruguai,
Venezuela e na região Sul do Brasil.
A
caracterização genética e molecular de E.
granulosus tem um papel fundamental no que diz respeito à compreensão mais
eficiente da epidemiologia da doença, bem como no controle e na prevenção desta
parasitose. Até hoje, não se teve nenhum registro de um paciente parasitado com
mais de um genótipo do parasito.
 |
Figura 3 - Imagem de microscópica de parasita adulto
Echinococcus. Fonte: www.cdc.gov.
|
O Echinococcus
(Figura 3) apresenta algumas particularidades que o permite diferenciar do
outro gênero da mesma família, o gênero Taenia,
nomeadamente o facto do parasita adulto ser pequeno, medindo apenas alguns
milímetros (dois a nove mm) apresentando um estróbilo com no máximo sete
segmentos.
O escólex tem quatro ventosas e uma dupla
fileira de 28 a 50 ganchos, tradicionalmente seguida de um pescoço, um proglótide
em desenvolvimento, um maturo e um gravídico. O último segmento tem geralmente
mais de metade do comprimento do cestode. O ovo tem uma forma ovoide e mede
32-36 µm x 25-30 µm. É constituído pelo embrião hexacanto ou oncosfera, que se
encontra envolvido pelo embrióforo que tem estriamento radial. A oncosfera tem
três pares de ganchos que servem para perfurar a parede intestinal, chegando
depois via sanguínea ou linfática ao órgão onde se irá desenvolver o quisto
hidático. O ovo de Echinococcus, morfologicamente, não se distingue do de
outros parasitas do gênero Taenia (Figura 4).
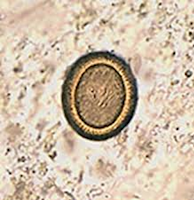 |
Figura 4 - Imagem de microscópica de
ovo de Taeniide.
|
Os cistos de Echinococcus
granulosus desenvolvem-se nos órgãos dos hospedeiros intermediários como
vesículas uniloculares em forma de “bexiga”, cheias de líquido. Os quistos
hidáticos são constituídos por duas membranas de origem parasitária e uma
produzida pelo hospedeiro (do interior para o exterior): membrana germinativa, é nucleada e a partir da qual são geradas
por reprodução assexuada as vesículas filhas e os protoescólices; membrana laminada ou cutícula, é acelular, forma-se duas a quatro
semanas após a infecção do hospedeiro intermediário e terá como função
principal a proteção; membrana adventícia, que é uma cápsula fibrosa produzida pelo
hospedeiro.
Para
completar seu ciclo biológico (Figura 5), helmintos pertencentes ao
gênero Echinococcus necessitam de dois hospedeiros: o hospedeiro
definitivo é representado sempre por um carnívoro (cão doméstico, raposa, lobo,
dentre outros), enquanto o hospedeiro intermediário, abrange um grupo maior de
mamíferos, que inclui desde herbívoros (ovinos, bovinos, suínos, caprinos,
dentre outros) até o homem. Entretanto, é importante citar que dentre os
hospedeiros intermediários, ovinos constituem a espécie animal mais
susceptível.
 |
Figura 5 - Ciclo de vida de Echinococcus spp. Fonte: Division of Parasitic
Diseases-CDC (www.cdc.gov/page.do.)
|
O parasito
adulto localiza-se junto à mucosa do intestino delgado de cães e demais
hospedeiros definitivos, onde os ovos produzidos são eliminados através das
fezes, contaminando o solo, pastagens e água. O fato dos ovos, em condições
favoráveis de temperatura e umidade, permanecerem viáveis no ambiente por vários
meses, facilita a infecção dos hospedeiros intermediários. Nos herbívoros, a
infecção ocorre através da ingestão de água e pastagens contaminadas com ovos,
enquanto que nos humanos, está se dá, além da ingestão de água e alimentos
contaminados, por hábitos mínimos de higiene por parte daqueles que convivem
com cães.
Os ovos
eclodem no estômago e/ou intestino delgado dos hospedeiros intermediários,
liberando o embrião, que através de seus acúleos (ganchos), penetram na mucosa
intestinal ganhando a corrente sanguínea, e desta, atingindo o fígado, coração,
pulmões, rins, dentre outros órgãos. Nos tecidos, o embrião inicia seu
desenvolvimento por intensa multiplicação e diferenciação celular, dando origem
à forma larval do Echinococcus spp., denominada de hidátide ou cisto
hidático. A hidátide consiste em uma “bolsa” cheia de líquido, cujo crescimento
é lento, e pode atingir proporções variáveis de acordo com o tecido onde está
instalada.
A ingestão
das vísceras do hospedeiro intermediário contendo a hidátide pelo hospedeiro
definitivo (cães e canídeos selvagens), levará a infecção deste. No intestino
dos carnívoros, a larva se fixa à mucosa do órgão, concluindo seu
desenvolvimento e iniciando outro ciclo evolutivo, com a eliminação de órgãos
pelas fezes em aproximadamente 45 dias.
Os sintomas
podem levar anos para aparecerem, pois, a evolução dos cistos ocorre
lentamente. A patogenia da hidatidose humana varia de acordo com o órgão
atingido, tamanho e número de cistos. No fígado e nos pulmões a doença pode se
apresentar de forma assintomática, caso haja apenas um único cisto, que não se
rompa e nem atinja grandes dimensões. No entanto, quando a doença atinge o
cérebro, torna-se grave, caso não seja diagnosticada e tratada rapidamente. Por
ocorrer em vários órgãos, a hidatidose sua patogenia e sintoma pode variar de
acordo com as funções vitais do órgão atingido. O fígado geralmente é órgão
primário da infecção (hidatidose hepática), e o pulmão é o segundo órgão mais
atingido (hidatidose pulmonar).
O quadro
clínico da hidatidose humana costuma ser assintomático e não é específico. Para
que se obtenha um diagnóstico preciso, é necessário que se leve em conta
informações clínicas, laboratoriais e epidemiológicas. As manifestações
clínicas, quando presentes, ocorrerão pela alta taxa de crescimento do cisto,
causando a compressão e aderência do órgão parasitado. Em alguns casos, os
cistos podem ser detectados nos exames físicos, ocorrendo a formação de massas
palpáveis, que se assemelham a tumores. Nas avaliações laboratoriais são
utilizadas técnicas como hemaglutinação, imunofluorescência e ELISA. Essas
avaliações devem estar presentes tanto no diagnóstico primário, quanto no acompanhamento
após o tratamento cirúrgico elou medicamentoso.
Recomenda-se
o uso de duas técnicas antes da confirmação do diagnóstico, pois há
possibilidade de ocorrer reações cruzadas. Exames de imagem como, a
radiografia, ecografia, ultrassonografia, cintilografia, tomografia
computadorizada e ressonância magnética, são utilizados para auxiliar no
diagnóstico. O diagnóstico em animais (equinococose canina), deve ser realizado
por meio do exame morfológico do parasito adulto e pela técnica ELISA de captura,
que atualmente tem apresentado excelentes resultados em estudos da prevalência
da equinococose. Nos hospedeiros intermediários (bovinos, ovinos, suínos) o
diagnóstico é realizado pela presença de cistos ao exame post-mortem, no
momento do abate destes animais. Estes dados, juntamente com os de equinococose
canina, são utilizados em áreas endêmicas para acompanhar a situação de risco
da população humana a hidatidose.
Como exemplo
de controle e erradicação iremos usar a terra clássica da hidatidose que foi a Islândia
onde 25% das pessoas autopsiadas eram positivas e 28% dos cães estavam
infectados com E. granulosus, porem
em 1864 foi iniciado um programa de controle e a prevalência caiu para 16% e
consequentemente 0% depois de 1960.
O conselho
de saúde assegurou o controle mediante a realização de inquéritos periódicos,
limitação da população canina, a destruição das vísceras parasitadas, um grande
trabalho de educação sanitária, proibição de vendas de carnes de rês não
abatida em matadouros, e interdição do acesso dos animais aos lugares de abate.
Além da erradicação da endemia na Islândia o controle foi muito eficaz em Nova
Zelândia e a Tasmânia.
Para
esgotar a fonte de ovos de Echinococcus dos
cães infectados a partir das vísceras de reses doentes, bastaria impedir que
estes cães se alimentassem de carne ou vísceras cruas tendo em vista que os
helmintos não duram mais que alguns meses na fase estrobilar. No entanto há
vários obstáculos que se opõe a essa erradicação como a decisão política e de
estruturas sanitárias e a estratégia de controle da infecção canina requer a
interdição do abate clandestino, melhoria dos matadouros, controle sanitário de
gado abatido, tratamento anti-helmíntico dos cães parasitados e redução da
população canina infectada.
Em Chipre
utilizaram fuzis que atiram seringas com material capaz de promover uma morte
indolor desses cães e a castração das cadelas, resultando no controle da
endemia entre os animais, no entanto o Rio Grande do Sul constatou uma
tendência para maior parasitismo entre os bovinos em relação aos ovinos.
Uma forma
de prevenir a infecção humana é em complemento as medidas acima, pode-se obter
a colaboração dos adultos para o tratamento dos cães incluindo o cozimento das
vísceras antes de oferecer aos cães, e principalmente obter uma cautela maior
com as crianças devido a sua intimidade perigosa com os animais suspeitos.
Referências:
ALMEIDA, F.; SPIGOLON,
Z., NEGRÃO, A. J. & NEVES, M. F. 2008. Echinococcus
granulosus. Revista Científica
Eletrônica de Medicina Veterinária. Ano VI:6.
BAYER - Saúde
Animal. Equinococose: Hidatidose humana.
2015. Disponível em:
http://www.bayervet.com.pt/pt/animais_companhia/parasitas/SG/zoonose/equinococose/equinoco_09.html>.
Acesso em: 14 de junho de 2017.
BOWMAN, D.
D.; LYNN, R. C. & EBERHARD, M. L. 2004. Georgis Parasitologia para
Veterinários, Elsevier. 8th Ed.
Madrid. 440pp.
DEPLAZES, P.;
VAN KNAPEN, F.; SCHWEIGER, A. & OVERGAAUW, P. A. M. 2011. Role of pet dogs
and cats in the transmission of helminthic zoonoses in Europe, with a focus on
echinococcosis and toxocarosis. Veterinary
Parasitology, 182, 41-53.
ECKERT, J.
& DEPLAZES, P. 1999. Alveolar echinococcosis in humans: The current
situation in Central Europe and the need for countermeasures. Parasitology Today, 15, 315-319.
ECKERT, J.,
GEMMELL, M. A., MESLIN, F.-X. & PAWŁOWSKI, Z. S. 2001. WHO/OIE Manual on Echinococcosis in Humans and
Animals: a Public Health Problem of Global Concern.
GOTTSTEIN,
B., DAI, W. J., WALKER, M., STETTLER, M., MULLER, N. & HEMPHILL, A. 2002.
An intact laminated layer is important for the establishment of secondary
Echinococcus multilocularis infection. Parasitology
Research, 88, 822-828.
HOFFMANN, A.
N. et al. Prevalência de Echinococcus
granulosus (Batsch, 1786) em cães urbanos errantes do município de Dom
Pedrito (RS), Brasil. Cienc. Rural, v.31
n.5, set./out. 2001.
MCMANUS, D.
P. & THOMPSON, R. C. A. 2003. Molecular epidemiology of cystic
echinococcosis. Parasitology, 127,
S37-S51.
MORO, P.
& SCHANTZ, P. M. 2009. Echinococcosis: a review. Int. J. Infect. Dis., 13, 125-33.
NEVES,
D. P. 2004.Parasitologia Humana. 11
ed. São Paulo: Atheneu.
REY,
L. 2001. Parasitologia. 3. ed. Rio de Janeiro: Guanabara Koogan S.A, 854 p.
ROJAS, C. A.
A., ROMIG, T. & LIGHTOWLERS, M. W. 2014.
Echinococcus granulosus sensu lato
genotypes infecting humans - review of current knowledge. International Journal for Parasitology, 44, 9-18.
TAYLOR, M.
A., COOP, R. L. & WALL, R. L. 2007. Veterinary Parasitology, Wiley Blackwell Publishing. 3rd Ed.
904pp.
ZHANG, W. B.,
LI, J. & MCMANUS, D. P. 2003. Concepts in immunology and diagnosis of
hydatid disease. Clinical Microbiology
Reviews, 16 (1): 18-36.


Comentários
Postar um comentário